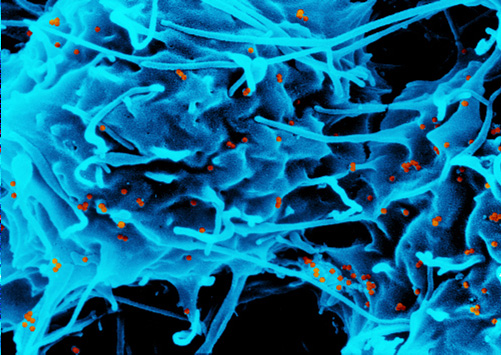
Eisen wird zu Stahl oder elektronischen Datenspeichermedien weiterverarbeitet. Auch in katalytischen Prozessen in der chemischen Industrie setzt man Eisenverbindungen ein. Weiterhin erforschen Wissenschaftler derzeit die Anwendung von Eisenoxid-Partikeln in der Medizin, z.B. als Kontrastmittel oder zur Tumortherapie. Eisen gehört zu den Metallen, die am häufigsten auf der Erde vorkommen. Seine Oxide werden als Eisenerz abgebaut.
 Wie könnte ich damit in Kontakt kommen?
Wie könnte ich damit in Kontakt kommen?
Eisen und Eisenoxid-Nanopartikel werden in elektronischen Geräten verwendet, um Daten aufzuzeichnen. Auf Festplatten werden die nanometerkleinen Strukturen zur Datenspeicherung benutzt; der Anwender kommt dabei mit den Partikeln nicht in Kontakt. Bei medizinischen Anwendungen werden die Partikel direkt in den Körper eingespritzt. Daher ist es wichtig, dass sie in den verwendeten Mengen nicht giftig sind.
Wie gefährlich ist das Material für Mensch und Umwelt?
Für medizinische Anwendungen werden im Vergleich zu den natürlichen Eisenspeichern im Körper nur geringe Mengen verabreicht, die nicht giftig sind. In der Umwelt sind natürliche Eisenoxide allgegenwärtig. Deshalb lassen sich künstlich hergestellte Eisenoxid-Nanopartikel dort schwer nachweisen, weil man sie nicht von den natürlichen unterscheiden kann. Von Umwelttechnikern wird das Material verwendet, um Schadstoffe im Grundwasser zu zerstören. Dort verbleiben die Partikel üblicherweise, nachdem die Chemikalien abgebaut wurden. Eisen und Eisenoxidnanopartikel werden für Organismen in der Umwelt als nicht giftig eingeschätzt – nur außergewöhnlich hohe Mengen sind problematisch. Allerdings muss hier deutlich zwischen den Wirkungen des metallischen Eisens und der verschiedenen Eisenoxid-Formen unterschieden werden, da Eisen von Organismen nicht aufgenommen wird. Eisenoxide hingegen sind wichtige Spurenelemente, die jedoch in zu hohen Mengen verabreicht negative Wirkungen haben können..
Fazit
Im Alltag ist der menschliche Körper nur geringen Mengen an nanoskaligem Eisen ausgesetzt, die als ungiftig betrachtet werden. In der Umwelt kommen Eisen und Eisenoxide auf natürliche Weise vor.
Nebenbei
- Eisenoxid wird auch als Farbpigment mit der typischen rostroten Farbe verwendet. Es ist als Farbstoff lange haltbar und schon in antiken Malereien zu sehen.
- Von Tauben oder Bakterien ist bekannt, dass sie magnetische Eisenoxid-Partikel in ihrem Körper einlagern,um sich damit am Erdmagnetfeld zu orientieren.

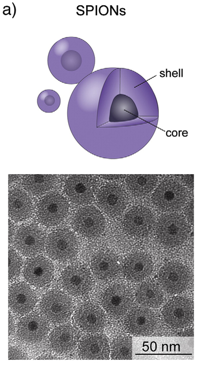

 In geringen
In geringen  Eisenoxid Nanopartikel sammeln sich auf Körperoberfläche und im Darm von Wasserflöhen und Salzkrebsen an. Für schädliche Effekte in hohen Konzentrationen werden die aus den Nanopartikeln freigesetzten Ionen und
Eisenoxid Nanopartikel sammeln sich auf Körperoberfläche und im Darm von Wasserflöhen und Salzkrebsen an. Für schädliche Effekte in hohen Konzentrationen werden die aus den Nanopartikeln freigesetzten Ionen und  Eine hohe Konzentration an Eisen Nanopartikeln führt auch in Faden- und Kompostwürmern zu oxidativen Stress und Wachstumsstörungen. Dies zeigt sich durch Wachstums- und Atmungshemmungen sowie Verletzungen der Haut.
Eine hohe Konzentration an Eisen Nanopartikeln führt auch in Faden- und Kompostwürmern zu oxidativen Stress und Wachstumsstörungen. Dies zeigt sich durch Wachstums- und Atmungshemmungen sowie Verletzungen der Haut. Für die Miesmuschel spielt es keine Rolle, ob Eisen Nanopartikel oder Eisensalze im Wasser enthalten sind. Die Kiemenzellen der Miesmuschel nehmen Eisenoxid Nanopartikel auf, die Atmung der Muscheln ist jedoch dadurch nicht beeinträchtigt.
Für die Miesmuschel spielt es keine Rolle, ob Eisen Nanopartikel oder Eisensalze im Wasser enthalten sind. Die Kiemenzellen der Miesmuschel nehmen Eisenoxid Nanopartikel auf, die Atmung der Muscheln ist jedoch dadurch nicht beeinträchtigt. In verschiedene Fischarten lösen Eisen und Eisenoxid Nanopartikel in hohen Konzentrationen ebenfalls oxidativen Stress aus und verursachen stärkere Effekte im Vergleich zu Eisensalzen, wie z.B. eine erhöhte Sterblichkeit bei Zebrabärblingen. Auf Kiemenzellen von Regenbogenforelle und Tilapia haben Eisenoxid Nanopartikel keinen Effekt.
In verschiedene Fischarten lösen Eisen und Eisenoxid Nanopartikel in hohen Konzentrationen ebenfalls oxidativen Stress aus und verursachen stärkere Effekte im Vergleich zu Eisensalzen, wie z.B. eine erhöhte Sterblichkeit bei Zebrabärblingen. Auf Kiemenzellen von Regenbogenforelle und Tilapia haben Eisenoxid Nanopartikel keinen Effekt. Bei Larven der Fruchtfliege lösen umweltrelevante, also relativ geringe Konzentrationen von Eisenoxid Nanopartikeln, keine schädlichen Effekte aus.
Bei Larven der Fruchtfliege lösen umweltrelevante, also relativ geringe Konzentrationen von Eisenoxid Nanopartikeln, keine schädlichen Effekte aus. Eisenoxid Nanopartikel lagern sich an die Oberfläche von Grünalgen an. Die damit verbundene Abschattung des Lichtes führte zu einem verringerten Wachstum der Algen, da diese auf das Sonnenlicht angewiesen sind.
Eisenoxid Nanopartikel lagern sich an die Oberfläche von Grünalgen an. Die damit verbundene Abschattung des Lichtes führte zu einem verringerten Wachstum der Algen, da diese auf das Sonnenlicht angewiesen sind. Eisen und Eisenoxid Nanopartikel werden für die Sanierung von verschmutzen Böden und Grundwasser eingesetzt und können daher von Pflanzen aufgenommen werden. Viele Pflanzen nehmen die Nanopartikel über die Wurzeln aus dem Wasser auf, jedoch nicht aus dem Boden. Die aufgenommenen Eisen und Eisenoxid Nanopartikel können in vielen Teilen der Pflanzen (Wurzeln, Sprosse, Blätter) nachgewiesen werden. Konzentrationsabhängig können diese Nanopartikel das Pflanzenwachstum beeinflussen: niedrige Konzentrationen fördern als Dünger das Wachstum, während hohe Konzentrationen an Nanopartikeln das Wachstum hemmen.
Eisen und Eisenoxid Nanopartikel werden für die Sanierung von verschmutzen Böden und Grundwasser eingesetzt und können daher von Pflanzen aufgenommen werden. Viele Pflanzen nehmen die Nanopartikel über die Wurzeln aus dem Wasser auf, jedoch nicht aus dem Boden. Die aufgenommenen Eisen und Eisenoxid Nanopartikel können in vielen Teilen der Pflanzen (Wurzeln, Sprosse, Blätter) nachgewiesen werden. Konzentrationsabhängig können diese Nanopartikel das Pflanzenwachstum beeinflussen: niedrige Konzentrationen fördern als Dünger das Wachstum, während hohe Konzentrationen an Nanopartikeln das Wachstum hemmen.