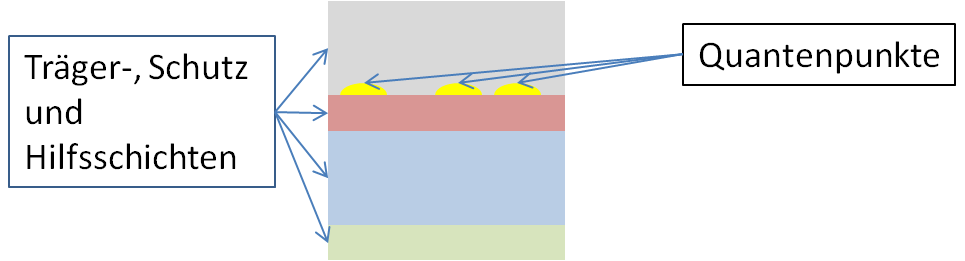
Während des Herstellungsprozesses könnten Arbeiter Quantenpunkte über die Lunge aufnehmen, verschlucken oder über die Haut mit ihnen in Kontakt kommen. Die biologische Wirkung von Quantenpunkten wird in der aktuellen Fachliteratur kontrovers diskutiert. Studien haben gezeigt, dass sich Quantenpunkte im Organismus verteilen und möglicherweise in unterschiedlichen Organen und Geweben anreichern können.
Allgemeine Gefährdung
Aufgrund ihrer optischen Eigenschaften haben Quantenpunkte viele Vorteile gegenüber bislang verwendeten organischen Farbstoffen. Sie sind daher perfekt für biologische Färbungen und Anwendungen in der Diagnostik geeignet . Darüber hinaus können sowohl Medikamente als auch sogenannte Zielmoleküle (wie beispielsweise Antikörper oder Peptide) an die Oberfläche von Quantenpunkten geheftet werden. Damit könnten Medikamente zelltyp- bzw. organspezifisch an ihren Wirkort gebracht werden . Eine solche direkte Anwendung im Körper (in vivo) setzt zumeist eine intravenöse Injektion der Partikel voraus. Daher beschäftigten sich auch diverse Studien damit, die Verteilung, Ausscheidung, den Metabolismus und die Toxizität von Quantenpunkten nach intravenöser Gabe zu untersuchen . Zudem wurde die Durchlässigkeit der Haut und das Verhalten von Quantenpunkten nach dem Schlucken im Magen-Darm-Trakt analysiert .
Untersuchungen am lebenden Organismus – in vivo
Wie sich die unterschiedlichsten Quantenpunkte im Körper verteilen, wurde in Mäusen und Ratten durch intravenöse Injektion nach verschiedenen Zeitpunkten analysiert . Einige Beispiele werden im Folgenden etwas genauer erläutert.
Nach ihrer Injektion in die Schwanzvene von Mäusen verteilten sich Quantenpunkte trotz unterschiedlicher Beschichtungen sofort im Blutkreislauf der Tiere. Innerhalb nur einer Stunde waren jedoch nahezu alle Quantenpunkte aus dem Blut verschwunden und konnten, abhängig von ihrer Beschichtung, in der Leber, der Haut oder im Knochenmark wiedergefunden werden . Lediglich eine ganz bestimmte Beschichtung verhinderte das schnelle Eliminieren aus der Blutbahn. Selbst 133 Tage nach der Injektion konnten die Quantenpunkte noch anhand ihrer starken Fluoreszenz detektiert werden. Das hohe Fluoreszenzsignal zeigt, dass bis dahin kein Abbau der Quantenpunkte im Organismus stattgefunden hat. Darüber hinaus konnte im Verlauf des gesamten Experiments keinerlei Zelltod in der Umgebung der Quantenpunkte beobachtet werden . Weitere Tierversuchsstudien hingegen berichten vom Verlust der Leuchtkraft – und damit dem Abbau– von Quantenpunkten mit anderen Beschichtungen . Möglicherweise schützen Beschichtungen mit höherem Molekulargewicht Quantenpunkte besser vor ihrem Abbau in vivo als kleinere Beschichtungsmoleküle (mit geringerem Molekulargewicht) .
In einer eher kurzen Studie (über einen Zeitraum von zehn Tagen) konnte in Ratten gezeigt werden, dass sich, abhängig von der Beschichtung, Quantenpunkte mehr oder weniger gut in der Leber und der Milz, sowie in geringerem Ausmaß auch in der Lunge und den Nieren anreichern können . Über die gesamte Versuchszeit blieben die verwendeten Quantenpunkte stabil (kein Abbau) und wurden weder über den Urin noch über den Kot ausgeschieden. Höchst wahrscheinlich waren diese Quantenpunkte zu groß für eine Ausscheidung über die Nieren .
In Übereinstimmung damit konnte in einer etwas längeren Studie (über 28 Tage) mit Mäusen gezeigt werden, dass sich Quantenpunkte in der Leber, der Milz und den Nieren ablagern, ohne ausgeschieden zu werden . Beobachtungen von Mäusen über einen Zeitraum von zwei Jahren (!) ergab, dass sich Quantenpunkte bereits kurz nach der Injektion in der Leber, der Milz, der Lymphe und dem Knochenmark befinden. Während das Signal in der Leber bereits nach fünf Tagen abschwächte, dauerte es bis zu sechs Monate bevor auch das Signal im Knochenmark anfing schwächer zu werden. Bemerkenswerter Weise blieb das Signal in der Lymphe bis zu zwei Jahre vorhanden. Quantenpunkte waren also auch noch nach zwei Jahren im Körper fluoreszierend und es konnte keinerlei Toxizität festgestellt werden .
Untersuchung außerhalb des Körpers – in vitro
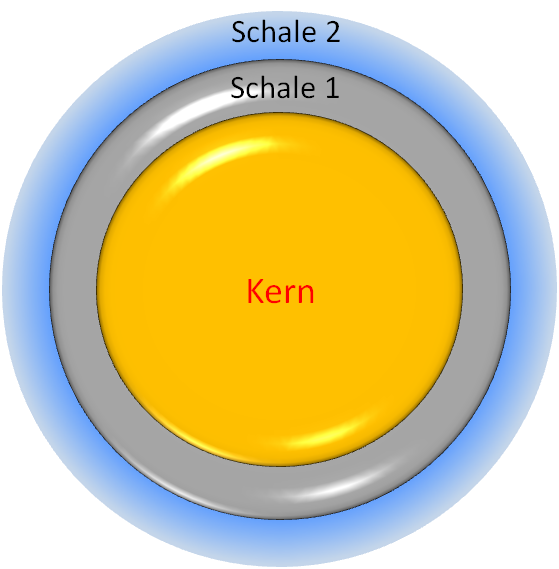
Quantenpunkte können aus verschiedenen Materialien hergestellt werden und weiterhin verschiedene Umhüllungen erhalten, daher kann es keine einheitlichen Reaktionen in Zellkulturen oder Tierversuchen geben. An dieser Stelle soll aber ein genereller Überblick helfen, diese besonderen Nanopartikel zu beurteilen. Viele unterschiedliche bzw. unterschiedlich modifizierte Quantenpunkte wurden in vitro in verschiedenen Zelltypen auf ihre mögliche Toxizität untersucht. Generell beeinflussen folgende physikalisch-chemische Eigenschaften der Quantenpunkte das Ausmaß ihrer biologischen Wirkungen: die Größe (Durchmesser), das Kern- sowie das Hüllmaterial, die Stabilität des Hüllmaterials, die Art der zusätzlichen Beschichtung, der gewählte Produktionsprozess sowie die Oberflächenladung. Darüber hinaus bestimmen sowohl der Zelltyp, in dem die Experimente durchgeführt wurden, als auch der gewählte Konzentrationsbereich die Resultate der Tests .
Verschiedene Hüll- und Beschichtungsmaterialien werden eingesetzt, um den Kern der Quantenpunkte zu schützen und die Freisetzung z.B. giftiger Cadmium-Ionen zu verhindern . Die Stabilität des kompletten Quantenpunkts hängt somit massgeblich von der Stabilität seiner Hülle und/oder seiner zusätzlichen Beschichtung ab. Wie stabil Quantenpunkte in lebenden Zellen oder auch im Organismus (vgl. Abschnitt "Exposition") sind, hängt u.a. davon ab, wo sie sich innerhalb einer Zelle genau befinden (vgl. Kapitel „Wirkung auf den Menschen – Aufnahmeverhalten in Zellen“) .
Im Gegensatz zu ihrer schützenden Funktion könnten die Beschichtungsmaterialien selbst einen schädigenden Effekt auf Zellen ausüben . Das Beschichtungsmaterial sollte daher für die Herstellung von Quantenpunkten für medizinische Zwecke gezielt und überlegt ausgewählt werden. Die sehr kleinen Quantenpunkte werden durch die zusätzliche Beschichtung stark vergrößert. Die Größe spielt, wie unter Kapitel „Wirkung auf den Menschen“ detaillierter beschrieben, bei der Ausscheidung von Quantenpunkte aus lebenden Organismen eine entscheidende Rolle.
Nicht nur die mögliche Freisetzung von schädlichen Cadmium-Ionen trägt zur Toxizität von Quantenpunkten bei, sondern auch ihre Fähigkeit reaktive Sauerstoffspezies (ROS) zu erzeugen . In höheren Konzentrationen verursachen diese Schäden in der Zelle, die durchaus bis zum Zelltod führen können . In zwei unterschiedlichen Zelltypen wurde die Verteilung von Quantenpunkten innerhalb der Zelle untersucht. Kleinere Quantenpunkte wurden vermehrt im Kern gefunden, größere hingegen im Zytoplasma . In der gleichen Studie konnte gezeigt werden, dass positiv geladene, kleinere Quantenpunkte giftiger waren als größere Quantenpunkte mit gleicher Ladung. Darüber hinaus fanden andere Wissenschaftler heraus, dass positiv geladene QD Zelltod in Leberzellen auslösen können .
Zusammenfassend lässt sich also sagen, dass die Oberflächenladung durchaus zur Toxizität von Quantenpunkten beitragen kann. Was jedoch die Größenabhängigkeit der Quantenpunkt-Giftigkeit angeht, lassen sich in der Fachliteratur auch gegensätzliche Ergebnisse finden. Beispielsweise wurden Quantenpunkte unabhängig von ihrer Größe gleich gut in verschiedene Zellen aufgenommen und dann auch ähnlich im Innern dieser Zellen verteilt. Es konnte in dieser Studie nach zehn Tagen noch keinerlei Giftigkeit gemessen werden .
Bislang bleibt auch ungeklärt, ob Quantenpunkte in Zellen eindringen müssen um diese negativ zu beeinflussen oder ob es ausreicht, von außen mit den Zellen in Kontakt zu kommen. Zum einen wurde gezeigt, dass erst mit Aufnahme der Quantenpunkte ins Zellinnere und dem Abbau des Cadmium-Kerns Zelltod eintritt . Zum anderen gibt es aber auch Ergebnisse, die zeigen, dass bereits das Ablagern von Quantenpunkten auf der Zelloberfläche ausreicht, um die Vitalität der Zelle zu beeinträchtigen – wenn auch auf andere Weise als von aufgenommenen Partikeln .
In mehreren Studien wurde über die generelle Vitalität der Zellen hinaus, im Speziellen die Schädigung ihres Erbmaterials (DNA) untersucht . Defekte im Erbmaterial können im besten Fall von Zellen repariert werden, ohne weitere Auswirkungen nach sich zu ziehen. Im schlimmsten Fall können solche Schäden jedoch zu Krebs und/oder erblichen Erkrankungen führen.
Der Abbau von DNA konnte sowohl in Gegenwart als auch in Abwesenheit von Licht durch Quantenpunkte hervorgerufen werden. Möglicherweise waren an dieser Reaktion reaktive Sauerstoffformen beteiligt . Aber auch die Kern- und Hüllmaterialien scheinen den Schweregrad der DNA-schädigenden Wirkung von Quantenpunkten mitzubestimmen. Partikel die lediglich aus einem Cadmium-Tellurid-Kern bestanden, lösten die höchste DNA-Schädigung aus. Eine zusätzliche Hülle machte die Quantenpunkte weniger schädlich. Die Verwendung eines anderen, ebenfalls umhüllten Kernmaterials verursachte letztendlich nahezu keine Verletzungen des Erbgutes .