Zink ist für alle Lebewesen in geringen Dosen lebenswichtig, in hohe Dosen toxisch. Diese Beobachtung spiegelt sich in den Ergebnissen zur Toxizität von nanoskaligem Zinkoxid wider. Zinkoxid Nanopartikel lösen sich generell schnell in Flüssigkeiten auf, so dass neben den Partikeln immer auch Ionen vorliegen. Deshalb gibt es für dieses Nanomaterial viele vergleichende Untersuchungen zur Wirkung von Zinksalz, Nanopartikel und Mikropartikeln in verschiedenen Umwelttestorganismen.
Zink und Zinkoxid wirken antibakteriell (Einsatz in Zinksalben). Zinkoxid Nanopartikel hemmen das Wachstum verschiedener Bakterienarten. Es wird angenommen, dass die Toxizität größtenteils von den freigesetzten Ionen ausgeht. Die Wachstumshemmung war unter Lichteinfluss verstärkt, und durch kleinere Partikel stärker als durch größere. Oxidativer Stress und eine Schädigung der äußeren Membran wird als Mechanismus der Toxizität vermutet. Weiterhin schädigen Zinkoxid Nanopartikel in einigen Bakterienarten das Erbgut. Durch die unterschiedliche Empfindlichkeit einzelner Bakterienarten verändert sich die Zusammensetzung von Bakteriengemeinschaften unter dem Einfluss von Zinkoxid Nanopartikeln. Die schädliche Wirkung von Zink in hohen Dosen kann Auswirkungen auf die zahlreichen wichtigen Funktionen haben, die Bakterien in der Umwelt übernehmen, beispielsweise die Stickstoff- und Methanfixierung .
 Die generellen Anzeichen einer Schädigung des Fisch-Organismus durch zu hohe Zink-Konzentrationen reichen von Entwicklungsverzögerungen bis zur Schädigung einzelner Organe oder des Immunsystems. Eine genauere Untersuchung des Wirkmechanismus ergab eine Bildung von reaktivem Sauerstoff durch Zinkoxidpartikel als mögliche Ursache der Toxizität. Einige Fischarten, jedoch nicht alle nehmen Zinkoxid Nanopartikel auf und Zink konnte in zahlreichen Geweben (Leber, Gehirn, Kiemen) nachgewiesen werden. In zahlreiche Fischstudien lösten die Nanopartikel einen stärkeren Effekt aus als Zink-Ionen. In einigen Studien wurde hingegen keinerlei Unterschied ermittelt. In jedem Fall wird den gelösten Ionen wird ein Teil der Wirkung zugeschrieben, welche offensichtlich durch die Partikel verstärkt werden kann .
Die generellen Anzeichen einer Schädigung des Fisch-Organismus durch zu hohe Zink-Konzentrationen reichen von Entwicklungsverzögerungen bis zur Schädigung einzelner Organe oder des Immunsystems. Eine genauere Untersuchung des Wirkmechanismus ergab eine Bildung von reaktivem Sauerstoff durch Zinkoxidpartikel als mögliche Ursache der Toxizität. Einige Fischarten, jedoch nicht alle nehmen Zinkoxid Nanopartikel auf und Zink konnte in zahlreichen Geweben (Leber, Gehirn, Kiemen) nachgewiesen werden. In zahlreiche Fischstudien lösten die Nanopartikel einen stärkeren Effekt aus als Zink-Ionen. In einigen Studien wurde hingegen keinerlei Unterschied ermittelt. In jedem Fall wird den gelösten Ionen wird ein Teil der Wirkung zugeschrieben, welche offensichtlich durch die Partikel verstärkt werden kann .
 Für Wasserflöhe ist Zink ab einer gewissen Konzentration toxisch. Organische Substanzen die natürlich in Gewässern vorkommen, können den toxischen Effekt der Zinkoxid Nanopartikel herabsetzen. Da Wasserflöhe das Wasser zur Nahrungsaufnahme filtrieren, gelangen Nanopartikel direkt in den Körper der Wasserflöhe, die sie aber wieder ausscheiden. In Wasserflöhen lösten Zinkoxid Nanopartikel gleiche toxische Wirkungen wie Ionen aus. Die Partikel waren umso schädlicher, je mehr Ionen sie freisetzten.
Für Wasserflöhe ist Zink ab einer gewissen Konzentration toxisch. Organische Substanzen die natürlich in Gewässern vorkommen, können den toxischen Effekt der Zinkoxid Nanopartikel herabsetzen. Da Wasserflöhe das Wasser zur Nahrungsaufnahme filtrieren, gelangen Nanopartikel direkt in den Körper der Wasserflöhe, die sie aber wieder ausscheiden. In Wasserflöhen lösten Zinkoxid Nanopartikel gleiche toxische Wirkungen wie Ionen aus. Die Partikel waren umso schädlicher, je mehr Ionen sie freisetzten.
Ähnliche Beobachtungen für Zinkoxid Nanopartikel wurden auch in einer Reihe weiterer Krebstiere sowie Plankton gemacht. Die Wirkung von Zinkoxid Nanopartikeln und Zink-Ionen unterschied sich in Kellerasseln nicht .
Der Einfluss von Zinkoxid Nanopartikeln auf Wachstum, Fortpflanzung und Verhalten von Fadenwürmern war mit dem von Zink-Ionen vergleichbar, wobei einige Ergebnisse auch auf eine stärkere Wirkung kleinerer Partikel hindeuten. Auch in Fadenwürmern verursachen die Partikel oxidativen Stress. Licht kann die Toxizität der Zinkoxid Nanopartikel verstärken. In Regenwürmern lösen Zinkoxid Nanopartikel ähnliche Effekte aus wie im Fadenwurm. Jedoch lösen bei diesem Organismus Ionen eine größere Toxizität aus als Nanopartikel .

Zinkoxid Nanopartikel werden von Muscheln und Schnecken aufgenommen und wirken in hohen Konzentrationen toxisch. Auch hier wurde oxidativer Stress als Wirkweise nachgewiesen. Gegenüber Seeigelembryonen wirkt Zink ebenfalls toxisch, hier sind vorrangig die freigesetzten Ionen für die Giftigkeit der Partikel verantwortlich. Eine andere Studie dahingegen zeigt, dass die Nanopartikel toxischer sind als die Ionen. Zudem wurde bewiesen, dass durch die Nanopartikel die Eihülle verändert wird, wodurch andere Kontaminanten in den Embryo gelangen könnten.

Krallenfroschembryonen nehmen Zinkoxid Nanopartikel ebenfalls auf. Die Partikel lösen oxidativen Stress aus, was zu einer Schädigung von Zellen führt .

Zinkoxid Nanopartikel beeinflussen das Nervensystem und senken die Überlebensrate von Bienen. Bei Springschwänzen bewirken Zinkoxid Nanopartikel und Zink-Ionen gleichermaßen Schädigungen im Erbgut und in der Fortpflanzungsfähigkeit. Die Größe der Partikel hat keinen Einfluss auf die toxische Wirkung. Die Tiere meiden mit Zink kontaminierten Boden .
 Für Algen ist Zink ein toxisches Element, die wirksame Komponente ist dabei das Zink-Ion. Sowohl Zinkoxid Nanopartikel als auch gröbere Partikel setzen diese Ionen in verschiedenen Anteilen frei, und sind daher auch für Algen toxisch. Inwieweit die schädliche Wirkung von Form und Größe der Partikel abhängt, wird unterschiedlich bewertet. Einige Studien finden keine Abhängigkeit, während andere eine gewisse Abhängigkeit sowohl von der Form, als auch der Größe der Partikel sehen. Zink löst in Algen eine verminderte Wachstumsrate und oxidativen Stress aus. Zinkoxid Nanopartikel werden in Algenzellen aufgenommen .
Für Algen ist Zink ein toxisches Element, die wirksame Komponente ist dabei das Zink-Ion. Sowohl Zinkoxid Nanopartikel als auch gröbere Partikel setzen diese Ionen in verschiedenen Anteilen frei, und sind daher auch für Algen toxisch. Inwieweit die schädliche Wirkung von Form und Größe der Partikel abhängt, wird unterschiedlich bewertet. Einige Studien finden keine Abhängigkeit, während andere eine gewisse Abhängigkeit sowohl von der Form, als auch der Größe der Partikel sehen. Zink löst in Algen eine verminderte Wachstumsrate und oxidativen Stress aus. Zinkoxid Nanopartikel werden in Algenzellen aufgenommen .

Zink kann auch für Pflanzen toxisch sein, wobei die einzelnen Arten unterschiedlich empfindlich sind. Überwiegend werden die aus den Nanopartikeln freigesetzten Ionen für die Pflanzentoxizität verantwortlich gemacht. In erster Linie sind die Wurzeln der Pflanzen in ihrem Wachstum beeinträchtigt, denn diese haben den ersten Kontakt mit den Zinkoxid Nanopartikeln. Für die Samen wurde eine verzögerte Keimung beobachtet. Zink wird in die Pflanzen aufgenommen und verteilt sich mehr oder weniger in Wurzeln, Spross, Blättern und Früchten. Auch in Pflanzen bewirken Zinkoxid Nanopartikel die Entstehung von oxidativem Stress .
Viele Arbeiten, jedoch nicht alle, führen die schädliche Wirkung des Zinks auf die Freisetzung von Ionen aus den Nanopartikeln zurück. Insgesamt lösen Partikel verschiedener Größen und Zink-Ionen ähnliche Symptome aus, beispielsweise oxidativen Stress, welcher in fast allen untersuchten Organismengruppen nachgewiesen wurde. Die Wirkstärke kann sich jedoch unterscheiden.
Weiterführende Literatur
- Weitere evaluierte Veröffentlichungen zu diesem Nanomaterial finden Sie hier (PDF; 85 KB )
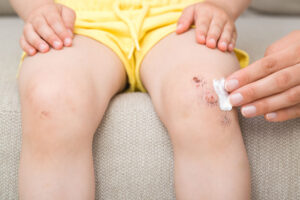 Wie könnte ich damit in Kontakt kommen?
Wie könnte ich damit in Kontakt kommen?

 Die generellen Anzeichen einer Schädigung des Fisch-Organismus durch zu hohe Zink-Konzentrationen reichen von Entwicklungsverzögerungen bis zur Schädigung einzelner Organe oder des Immunsystems. Eine genauere Untersuchung des Wirkmechanismus ergab eine Bildung von reaktivem Sauerstoff durch Zinkoxidpartikel als mögliche Ursache der Toxizität. Einige Fischarten, jedoch nicht alle nehmen Zinkoxid Nanopartikel auf und Zink konnte in zahlreichen Geweben (Leber, Gehirn, Kiemen) nachgewiesen werden. In zahlreiche Fischstudien lösten die Nanopartikel einen stärkeren Effekt aus als Zink-Ionen. In einigen Studien wurde hingegen keinerlei Unterschied ermittelt. In jedem Fall wird den gelösten Ionen wird ein Teil der Wirkung zugeschrieben, welche offensichtlich durch die Partikel verstärkt werden kann .
Die generellen Anzeichen einer Schädigung des Fisch-Organismus durch zu hohe Zink-Konzentrationen reichen von Entwicklungsverzögerungen bis zur Schädigung einzelner Organe oder des Immunsystems. Eine genauere Untersuchung des Wirkmechanismus ergab eine Bildung von reaktivem Sauerstoff durch Zinkoxidpartikel als mögliche Ursache der Toxizität. Einige Fischarten, jedoch nicht alle nehmen Zinkoxid Nanopartikel auf und Zink konnte in zahlreichen Geweben (Leber, Gehirn, Kiemen) nachgewiesen werden. In zahlreiche Fischstudien lösten die Nanopartikel einen stärkeren Effekt aus als Zink-Ionen. In einigen Studien wurde hingegen keinerlei Unterschied ermittelt. In jedem Fall wird den gelösten Ionen wird ein Teil der Wirkung zugeschrieben, welche offensichtlich durch die Partikel verstärkt werden kann . Für Wasserflöhe ist Zink ab einer gewissen
Für Wasserflöhe ist Zink ab einer gewissen 



 Für Algen ist Zink ein toxisches Element, die wirksame Komponente ist dabei das Zink-Ion. Sowohl Zinkoxid Nanopartikel als auch gröbere Partikel setzen diese Ionen in verschiedenen Anteilen frei, und sind daher auch für Algen toxisch. Inwieweit die schädliche Wirkung von Form und Größe der Partikel abhängt, wird unterschiedlich bewertet. Einige Studien finden keine Abhängigkeit, während andere eine gewisse Abhängigkeit sowohl von der Form, als auch der Größe der Partikel sehen. Zink löst in Algen eine verminderte Wachstumsrate und oxidativen Stress aus. Zinkoxid Nanopartikel werden in Algenzellen aufgenommen .
Für Algen ist Zink ein toxisches Element, die wirksame Komponente ist dabei das Zink-Ion. Sowohl Zinkoxid Nanopartikel als auch gröbere Partikel setzen diese Ionen in verschiedenen Anteilen frei, und sind daher auch für Algen toxisch. Inwieweit die schädliche Wirkung von Form und Größe der Partikel abhängt, wird unterschiedlich bewertet. Einige Studien finden keine Abhängigkeit, während andere eine gewisse Abhängigkeit sowohl von der Form, als auch der Größe der Partikel sehen. Zink löst in Algen eine verminderte Wachstumsrate und oxidativen Stress aus. Zinkoxid Nanopartikel werden in Algenzellen aufgenommen .