Die Plazenta ist eine wichtige Gewebeschranke, die das ungeborene Kind von der Mutter trennt. Dieses ist dabei vollständig abhängig vom richtigen Funktionieren der Plazenta, da sie für die Versorgung mit Sauerstoff und Nahrung zuständig ist, aber auch Kohlenstoffdioxid und Abfallstoffe abtransportiert. In diesen Prozessen können auch Nanopartikel transportiert werden und den Fötus erreichen.
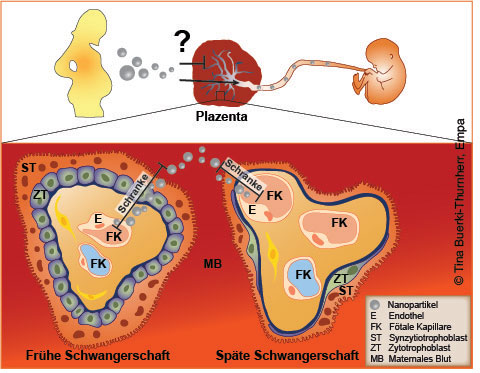
Die Plazentaschranke besteht aus zwei Anteilen, einem mütterlichen und einem fetalen Anteil. In der frühen Schwangerschaft ist das plazentale Gewebe sehr dick, um den sich entwickelnden Fötus zu schützen. Im weiteren Verlauf der Schwangerschaft wird diese Gewebeschranke immer dünner, vor allem dadurch bedingt, dass die Versorgungsleistung mit Sauerstoff und Nährstoffen erheblich zunehmen muss.
Die Plazenta erfüllt eine Reihe von Aufgaben vom Transport bis hin zur hormonellen und immunologischen Unterstützung der Schwangerschaft. Obwohl die Plazenta eine natürliche Barriere für viele Substanzen darstellt, hat der Contergan-Skandal in den 1950er und 1960er Jahren gezeigt, dass dieses Organ für Fremdstoffe nicht völlig undurchlässig ist. Heutzutage ist die Tatsache akzeptiert, dass verschiedene Umweltschadstoffe sowie Alkohol, Medikamente und Drogen diese Schranke durchdringen können. Daher geht auch mit der Produktion und der Nutzung von Nanomaterialien die Befürchtung einher, dass diese möglicherweise ebenfalls über diese Schranke wandern können und eventuell einen negativen Effekt auf den Embryo und seine Entwicklung haben können.
In der nahen Vergangenheit wurden einige Studien durchgeführt, um sowohl den Transport von Nanopartikeln über die Plazentaschranke zu untersuchen, als auch nach möglichen toxischen Effekten zu suchen, die das Plazentagewebe oder die embryonale Entwicklung beeinflussen könnten. Solche Studien sind jedoch noch selten und somit ist das vorhandene Wissen über Transport und Auswirkungen auf die Plazenta ebenfalls noch sehr begrenzt. Alternative Testansätze werden benötigt, da keine Versuche mit schwangeren Frauen durchgeführt werden. Aktuelle Studien nutzen Tierversuche (meist an Mäusen), in vitro Zellkultur Versuche oder das ex vivo Modell mit der menschlichen Plazenta zur Untersuchung der möglichen Effekte und dem Transportverhalten der Nanopartikel.
Untersuchungen an Mäusen
Die Behandlung von schwangeren Mäusen mit verschiedenen Nanopartikeln (z.B. Titandioxid, Siliziumdioxid, Kohlenstoff-Nanoröhrchen) hat zu Komplikationen der Schwangerschaft geführt oder Schäden an den Mäuse-Föten hervorgerufen [1-7]. Andere Studien zeigten jedoch einen Transport ohne nachteilige Auswirkungen (z.B. bei Gold-Nanopartikeln) [8, 9]. Interessanterweise wurden negative Effekte auf die Föten auch beobachtet, wenn die Nanopartikel die Plazentaschranke gar nicht passierten und somit nicht direkt den Fötus beeinflussten. Auch wenn dies erste Hinweise auf eine mögliche Beeinflussung der Schwangerschaft sein könnten, so ist aufgrund der geringen Anzahl von Studien und des schlechten Vergleichs des tierischen Modells zum Menschen keine wirkliche Aussage möglich, denn jede Säugetierspezies hat eine einzigartige anatomische Struktur der Plazenta.
Das Plazentaperfusionsmodell
Augenblicklich ist das Plazentaperfusionsmodell der „Gold-Standard“ für Untersuchungen ex vivo. Dieses lässt direkte Experimente an der menschlichen Plazenta nach Kaiserschnittentbindungen zu. Erste Versuche mit diesem Modell haben gezeigt, dass der Transport der Nanopartikel durch die Plazenta abhängig von der Gröβe der Partikel ist, aber auch von deren Materialzusammensetzung und den Oberflächen-Beschaffenheiten [10-13]. Auβerdem konnte gezeigt werden, dass der Transport von der Mutter zum Fötus deutlich langsamer oder schlechter funktioniert, als umgekehrt, was auf einen energieabhängigen, aktiven Transport schließen lässt [14]. Neben den großen Vorteilen dieses Modells sind vor allem der niedrige Durchsatz und die kurze Behandlungszeit nachteilig.
In vitro Modelle
Im Gegensatz zum Plazentaperfusionsmodell versprechen in vitro Zellkulturmodelle schnelle Hoch-Durchsatz-Versuche, um eine große Zahl verschiedener Nanomaterialien untersuchen zu können. Obwohl diese weniger aussagekräftig für eine in vivo Situation sind, erlauben sie erste Beurteilungen der Nanopartikel. Neben vielen anderen haben sich hier besonders die sogenannten BeWo-Zellen etabliert, die von einem menschlichen Tumorgewebe stammen und die Zellschranke auf der mütterlichen Seite darstellen. Für Transportexperimente werden diese Zellen auf porösen Membranen ausgesät und in ein Zwei-Kammer-System eingesetzt, in dem in die obere Kammer Substanzen oder Nanopartikel zugegeben werden können und der Transport in die untere Kammer verfolgt werden kann. Versuche mit diesem Modell konnten einen Transfer für z.B. Polystyrol-, Siliziumdioxid-, oder Eisenoxid-Partikel nachweisen [13,15-17].
Neben der Nanosicherheitsforschung stehen aber auch mögliche Anwendungen von Nanomaterialien in medizinischen Therapien im wissenschaftlichen Fokus. Die Zahl schwangerer Frauen, die medikamentös behandelt werden müssen, ist relativ hoch und steigt kontinuierlich an, wobei das damit einhergehende Risiko durch die Medikamente bekannt ist [18]. Die Nanomedizin kann hier unter Umständen neue Therapiekonzepte ermöglichen, um nur die Mutter, die Plazenta oder den Fötus zu behandeln mit dem Ziel Nebenwirkungen zu minimieren oder gar Schädigungen komplett zu vermeiden. Dies könnte mit Nanopartikeln erreicht werden, die gar nicht oder verbessert durch die Plazenta hindurch transportiert werden oder sich in der Plazenta anreichern. Daher ist es sehr wichtig, nicht nur die Aufnahme- und Transportmechanismen für Nanopartikel zu kennen, sondern auch die mögliche Beeinflussung dieser Prozesse über die physiko-chemischen Eigenschaften oder eine Oberflächenfunktionalisierung zu erforschen.
Literatur ![]()
- Hougaard, K S et al. (2010), Part Fibre Toxicol, 7, 16
- Shimizu, M et al. (2009), Part Fibre Toxicol, 6: 20
- Yamashita, K et al. (2011), Nat Nanotechol, 6: 321-8
- Campagnolo, L et al. (2013), Part Fibre Toxicol, 10: 21
- Pietroiusti, A et al. (2011), ACS Nano, 5: 4624-33
- Huang, X et al. (2014), Biomaterials, 35: 856-65
- Qi, W et al. (2014), Sci Rep, 4: 4352
- Tian, X et al. (2013), Small, 9: 2432-9
- Yang, H et al. (2012), Sci Rep, 2: 847
- Wick, P et al. (2010), Environ Health Perspect, 118(3): 432-436
- Menjoge, A R et al. (2011), J Control Release, 150: 326-38
- Myllynen, P K et al. (2008), Reprod Toxicol, 26: 130-7
- Sønnegaard Poulsen, M et al. (2015), Nanotoxicology, 9(S1): 79-86
- Grafmüller, S et al. (2015), Environ Health Perspect
- Ali, H et al. (2013), Int J Pharm, 454: 149-57
- Cartwright, L et al. (2012), Int J Nanomedicine, 7: 497-510
- Correira Carreira, S et al. (2015), Nanotoxicology, 9: 66-78
- Daw, J R et al. (2011), Pharmacoepidemiol Drug Saf, 20(9): 895-902