Katalyse beschreibt eines der bedeutendsten Grundprinzipien der Chemie: Mit Unterstützung durch einen Hilfsstoff, der Katalysator genannt wird, verläuft eine chemische Reaktion schneller, energiegünstiger bzw. in eine bevorzugte Richtung im Vergleich zu einer nicht-katalysierten Reaktion. Der Katalysator wird im Idealfall bei der Reaktion nicht verbraucht.

Viele katalytische Reaktionen führen zu Produkten, die ohne Katalysator nicht in ausreichender Menge zu erhalten wären. Oder der Katalysator begünstigt die Reaktion zum gewünschten Produkt, und die Bildung von nicht erwünschten Produkten wird verringert. Dadurch werden dann Energie und Rohstoffe eingespart.
In der chemischen Industrie tragen katalytische Prozesse sehr häufig zu nachhaltigen und umweltfreundlichen, zugleich aber auch wirtschaftlichen Produktionsverfahren bei. Aber auch bei der Behandlung von Abfällen und Abgasen helfen Katalysatoren, chemische Reaktionen in eine günstige Richtung zu verschieben, damit unerwünschte Neben- und Abfallprodukte in kleinerer Menge anfallen und ggf. weniger schädlich sind.
Auch in der Natur und im Menschen laufen katalytische Prozesse ab, das wird dann enzymatische Katalyse, Bio-Katalyse oder als Spezialfall auch Ganzzell-Biokatalyse genannt, vgl. unseren Artikel zur Biokatalyse. Sie werden auch in der Industrie genutzt. Ohne diese biologischen katalytischen Prozesse gäbe es kein Leben auf der Erde.
Autoabgaskatalyse
Das wohl bekannteste Beispiel für einen katalytischen Prozess findet sich im Autoabgaskatalysator. Er verringert die Menge der Schadstoffe im Autoabgas wesentlich. Unter anderem gleicht ein Autoabgaskatalysator die ohne Katalysator im Abgas bevorzugt ablaufende Reaktion von Stickstoff zu Stickoxiden aus. Je nach Art des Motors und Katalysators werden die Stickoxide mit Hilfe eines Edelmetall-Katalysators entweder durch andere Abgasbestandteile oder durch Harnstofflösung (AdBlue®) reduziert, sodass nur Stickstoff im Autoabgas ausgestoßen wird. Dadurch vermeidet man, dass das Auto die Stickoxide ausstößt, die mit Wasser zu Salpetersäure und anderen Stickstoffsäuren reagieren. Diese verursachen sauren Regen und tragen zum Baumsterben bei.
Spuren der Edelmetalle in Autoabgaskatalysatoren, z.B. Platin und Palladium, werden beim Gebrauch aus dem Katalysator ausgetragen. Diese landen dann in der Umwelt und speziell am Rand von Straßen. Bisher haben Wissenschaftlerinnen und Wissenschaftler aber noch keine Hinweise gefunden, dass durch die geringen Mengen solcher Edelmetalle Schäden in der Umwelt entstehen. Für den Fall, dass in Zukunft Hinweise auf solche negativen Auswirkungen gefunden würden, muss man damit verbundenen Befürchtungen auch eine massive Schädigung der Umwelt durch Autoabgase und damit den sauren Regen gegenüberstellen, würde man keine Autoabgaskatalyse einsetzen.
Katalyse in der chemischen Industrie

In der chemischen Industrie werden die meisten Prozesse (~80 %) zur Herstellung von Chemikalien und Materialien mit Hilfe von Katalysatoren energie- und rohstoffsparender gestaltet. Damit sind katalytische Prozesse wichtige Hilfsmittel der Chemiker. Sie sparen der Industrie Ausgaben, verringern Umweltbelastungen und sind ein entscheidendes Hilfsmittel für eine nachhaltige Gesellschaft.
Eine der bedeutendsten katalytischen Synthesen der Chemie findet im Haber-Bosch Verfahren zur Erzeugung von Ammoniak statt. Ammoniak (NH3) wird durch die direkte Reaktion von Wasserstoff (H2) und Stickstoff (N2) mit Hilfe eines Eisenoxid-basierten Katalysators hergestellt. Ohne Katalysator kann man bei der Reaktion keine wirtschaftlich verwertbare Ausbeute erzielen. Das katalytische Haber-Bosch-Verfahren ermöglicht hingegen die heute gängige Produktion von Ammoniak im Millionen Tonnen Maßstab. Ammoniak wird zu Düngemitteln weiterverarbeitet, welche die Versorgung der meisten Länder mit Lebensmitteln sicherstellen. Für die katalytische Herstellung von Ammoniak benötigt man hohe Temperaturen (z.B. 400 °C) und hohe Drücke (z.B. 200 bar).
Obwohl mit dieser katalytischen Reaktion die industrielle Ammoniakherstellung erst möglich wurde, geht es noch besser: die Natur hat Systeme entwickelt, die in Bakterien an den Wurzeln von Leguminosen (dazu gehören Hülsenfrüchte wie z.B. Erbsen) mit Hilfe des Enzyms Nitrogenase bei Raumtemperatur (20 °C) und Atmosphärendruck (1 bar) Ammoniak herstellen. Er dient der Düngung der Pflanzen. Bislang ist es aber noch nicht gelungen, diese natürlichen katalytischen Reaktionen in künstlichen Systemen nachzustellen. Das Beispiel zeigt aber eindrucksvoll, warum nach wie vor intensiv an katalytischen Prozessen geforscht wird. Es ist weiterhin noch viel Potential für Verbesserungen katalytischer Systeme vorhanden.
Katalysatorsysteme und -Komponenten
Katalytische Prozesse sind in der chemischen Synthese weitverbreitet. Eine Idee zur Bandbreite der als Katalysatoren eingesetzten Metalle gibt die folgende Liste. Je nach der gewünschten Reaktion werden unterschiedliche Katalysatoren eingesetzt. Oft gibt es auch mehrere Katalysatoren, welche die gleiche Reaktion begünstigen:
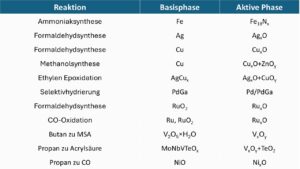
Autoabgaskatalysatoren enthalten die Edelmetalle Platin, Palladium bzw. Rhodium. Ebenso setzt die chemische Industrie in katalytischen Prozessen Metalle ein. Darunter sind wieder die Edelmetalle. Da speziell Edelmetalle teuer sind und einige Metalle für Mensch und Umwelt schädlich sein können (z.B. Cobalt oder Chrom), versuchen Forschende die Menge der eingesetzten Metalle in Katalysatoren zu verringern und die Edelmetalle soweit möglich zu ersetzen. Vielfach ist das auch unter Nachhaltigkeitsaspekten sinnvoll, beispielsweise dann, wenn die erforderlichen Edelmetalle aus Minen in Ländern mit unzureichendem Arbeitsschutz oder Kinderarbeit stammen.
Forschungsarbeiten im Bereich der Katalyse werden auch in der Förderung MaterialNeutral vom BMBF unterstützt, da dadurch wichtige Ressourcen wie Energie und Rohstoffe in großer Menge eingespart werden können.
Literartur:
- Schlögl, R (2015), Angewandte Chemie, 127(11): 3531-3589.